Pureté de l’Eau par Titration de l’HCl : Détermination de l'Alcalinité
Comprendre la Titration pour Évaluer la Pureté de l'Eau
La titration est une technique de chimie analytique quantitative utilisée pour déterminer la concentration d'une substance dissoute (l'analyte) en la faisant réagir avec une solution de concentration connue (le titrant). Dans le contexte de la qualité de l'eau, la titration avec de l'acide chlorhydrique (HCl) est couramment employée pour mesurer l'alcalinité de l'eau. L'alcalinité représente la capacité de l'eau à neutraliser les acides et est principalement due à la présence d'ions bicarbonate (\(\text{HCO}_3^-\)), carbonate (\(\text{CO}_3^{2-}\)) et hydroxyde (\(\text{OH}^-\)). Une alcalinité trop élevée ou trop faible peut affecter les écosystèmes aquatiques et l'adéquation de l'eau à divers usages. Ce paramètre est donc un indicateur de sa "pureté" ou de sa composition chimique.
Données de l'étude
- Volume de l'échantillon d'eau de rivière (\(V_{\text{eau}}\)) : \(100.0 \, \text{mL}\)
- Concentration de la solution titrante d'acide chlorhydrique (\(C_{\text{HCl}}\)) : \(0.0200 \, \text{mol/L}\)
- Volume d'HCl versé pour atteindre le point de virage de l'indicateur (correspondant à la neutralisation de l'alcalinité totale) (\(V_{\text{HCl}}\)) : \(8.50 \, \text{mL}\)
- Masse molaire du carbonate de calcium (\(M_{\text{CaCO}_3}\)) : \(100.09 \, \text{g/mol}\)
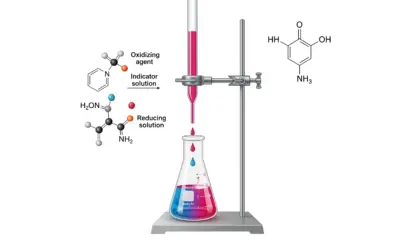
Schéma du Montage de Titration Acido-Basique
Titration d'un échantillon d'eau avec une solution d'HCl.
Questions à traiter
- Convertir le volume de l'échantillon d'eau en litres (L).
- Convertir le volume d'HCl versé en litres (L).
- Calculer le nombre de moles d'HCl (\(n_{\text{HCl}}\)) utilisées pour la titration.
- Déterminer le nombre de moles d'équivalent \(\text{CaCO}_3\) (\(n_{\text{CaCO}_3}\)) dans l'échantillon d'eau. (Rappel : 2 moles d'HCl neutralisent l'alcalinité équivalente à 1 mole de \(\text{CaCO}_3\)).
- Calculer la masse de \(\text{CaCO}_3\) (\(m_{\text{CaCO}_3}\)) correspondante dans l'échantillon.
- Calculer l'alcalinité totale de l'eau en mg de \(\text{CaCO}_3\) par litre d'eau (mg/L \(\text{CaCO}_3\)).
Correction : Calcul de l'Alcalinité de l'Eau
Question 1 : Conversion du Volume de l'Échantillon d'Eau en Litres
Principe :
Le volume est donné en millilitres (mL) et doit être converti en litres (L) pour les calculs de concentration.
Relation :
Données spécifiques :
- Volume de l'échantillon d'eau (\(V_{\text{eau}}\)) : \(100.0 \, \text{mL}\)
Calcul :
Question 2 : Conversion du Volume d'HCl Versé en Litres
Principe :
De même, le volume d'HCl est donné en millilitres (mL) et doit être converti en litres (L).
Relation :
Données spécifiques :
- Volume d'HCl versé (\(V_{\text{HCl}}\)) : \(8.50 \, \text{mL}\)
Calcul :
Quiz Intermédiaire 1 : Un volume de 5.0 mL de titrant est équivalent à :
Question 3 : Calcul du Nombre de Moles d'HCl Utilisées (\(n_{\text{HCl}}\))
Principe :
Le nombre de moles (\(n\)) d'un soluté est calculé en multipliant sa concentration molaire (\(C\)) par le volume de la solution (\(V\)).
Formule(s) utilisée(s) :
Données spécifiques :
- Concentration de HCl (\(C_{\text{HCl}}\)) : \(0.0200 \, \text{mol/L}\)
- Volume d'HCl versé (\(V_{\text{HCl}}\)) : \(0.00850 \, \text{L}\)
Calcul :
Question 4 : Détermination du Nombre de Moles d'Équivalent \(\text{CaCO}_3\) (\(n_{\text{CaCO}_3}\))
Principe :
L'alcalinité totale est souvent exprimée en termes d'équivalent \(\text{CaCO}_3\). La stœchiométrie de la réaction de neutralisation de l'alcalinité (principalement sous forme d'ions bicarbonate et carbonate) par l'HCl est telle que 2 moles d'ions \(\text{H}^+\) (provenant de l'HCl) sont nécessaires pour neutraliser l'alcalinité correspondant à 1 mole de \(\text{CaCO}_3\). Autrement dit, 1 mole d'HCl neutralise un équivalent d'alcalinité qui correspond à 1/2 mole de \(\text{CaCO}_3\).
Réactions simplifiées :
\(\text{CO}_3^{2-} + 2\text{H}^+ \rightarrow \text{H}_2\text{CO}_3\)
\(\text{HCO}_3^- + \text{H}^+ \rightarrow \text{H}_2\text{CO}_3\)
Pour exprimer en \(\text{CaCO}_3\), on considère que \(\text{CaCO}_3 \equiv 2 \text{ équivalents d'alcalinité}\). Donc, 1 mole de \(\text{CaCO}_3\) réagit avec 2 moles d'HCl.
Relation stœchiométrique :
Données calculées :
- Nombre de moles d'HCl (\(n_{\text{HCl}}\)) : \(1.70 \times 10^{-4} \, \text{mol}\)
Calcul :
Question 5 : Calcul de la Masse de \(\text{CaCO}_3\) Correspondante
Principe :
La masse (\(m\)) d'une substance est obtenue en multipliant son nombre de moles (\(n\)) par sa masse molaire (\(M\)).
Formule(s) utilisée(s) :
Données spécifiques et calculées :
- Nombre de moles de \(\text{CaCO}_3\) (\(n_{\text{CaCO}_3}\)) : \(8.50 \times 10^{-5} \, \text{mol}\)
- Masse molaire de \(\text{CaCO}_3\) (\(M_{\text{CaCO}_3}\)) : \(100.09 \, \text{g/mol}\)
Calcul :
Conversion en milligrammes (mg) :
Arrondi à trois chiffres significatifs (comme \(V_{\text{HCl}}\)) : \(8.51 \, \text{mg}\).
Question 6 : Calcul de l'Alcalinité Totale en mg/L de \(\text{CaCO}_3\)
Principe :
L'alcalinité totale est exprimée comme la masse d'équivalent \(\text{CaCO}_3\) par litre d'eau. On divise la masse de \(\text{CaCO}_3\) calculée par le volume de l'échantillon d'eau en litres.
Formule(s) utilisée(s) :
Données calculées :
- Masse de \(\text{CaCO}_3\) (\(m_{\text{CaCO}_3}\)) : \(8.51 \, \text{mg}\)
- Volume de l'échantillon d'eau (\(V_{\text{eau}}\)) : \(0.1000 \, \text{L}\)
Calcul :
Quiz Intermédiaire 2 : Si l'alcalinité d'une eau est de 50 mg/L \(\text{CaCO}_3\) et que vous analysez 200 mL d'échantillon, quelle masse de \(\text{CaCO}_3\) équivalente est présente dans ces 200 mL ?
Quiz Rapide : Testez vos connaissances (Récapitulatif)
1. L'alcalinité d'une eau représente sa capacité à :
2. Lors d'une titration acido-basique, le point de virage de l'indicateur signale :
3. Si on utilise 10 mL d'HCl 0.01 M pour titrer l'alcalinité d'un échantillon, combien de moles d'HCl ont été utilisées ?
Glossaire
- Titration (ou Dosage)
- Méthode d'analyse chimique quantitative permettant de déterminer la concentration d'une espèce chimique (analyte) dans une solution, en la faisant réagir avec une autre espèce chimique de concentration connue (titrant).
- Analyte
- Espèce chimique dont on cherche à déterminer la concentration ou la quantité lors d'une analyse.
- Titrant
- Solution de concentration précisément connue utilisée dans une titration pour réagir avec l'analyte.
- Alcalinité
- Mesure de la capacité de l'eau à neutraliser les acides. Elle est due principalement aux ions bicarbonate (\(\text{HCO}_3^-\)), carbonate (\(\text{CO}_3^{2-}\)) et hydroxyde (\(\text{OH}^-\)).
- Point d'Équivalence
- Point théorique d'une titration où la quantité de titrant ajoutée est stœchiométriquement égale à la quantité d'analyte présente dans l'échantillon.
- Point de Virage (ou Point Final)
- Point observé expérimentalement lors d'une titration, souvent grâce à un changement de couleur d'un indicateur ou à une variation brusque d'une propriété physique (pH, potentiel), qui est supposé être proche du point d'équivalence.
- Carbonate de Calcium (\(\text{CaCO}_3\))
- Composé chimique souvent utilisé comme référence pour exprimer l'alcalinité et la dureté de l'eau.
- Masse Molaire (\(M\))
- Masse d'une mole d'une substance, exprimée en g/mol.
D’autres exercices de chimie analytique:






0 commentaires