Analyse Quantitative de Fe²⁺ dans l’Eau de Source par Titration Redox
Comprendre l'Analyse Quantitative du Fer(II) par Titration Redox
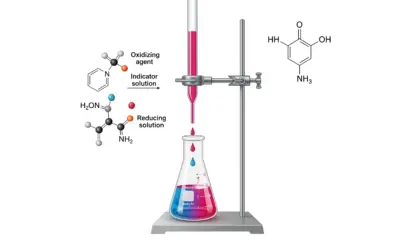
La détermination de la concentration en ions ferreux (Fe²⁺) dans les échantillons d'eau est importante pour évaluer sa qualité, car le fer peut affecter le goût, la couleur et favoriser la croissance de certaines bactéries. La titration redox est une méthode volumétrique courante pour quantifier le Fe²⁺. Elle implique la réaction d'oxydoréduction entre les ions Fe²⁺ (qui sont oxydés en Fe³⁺) et un agent oxydant de concentration connue, comme le permanganate de potassium (KMnO₄). Le point d'équivalence est détecté par un changement de couleur, souvent celui du permanganate lui-même qui passe d'une couleur violette intense à incolore (ou une légère persistance de la teinte rose) lorsque tout le Fe²⁺ a réagi.
Données de l'étude
- Volume de l'échantillon d'eau de source (\(V_{\text{eau}}\)) : \(50.0 \, \text{mL}\)
- L'échantillon d'eau est acidifié avant la titration.
- Solution titrante : Permanganate de potassium (KMnO₄)
- Concentration de la solution de KMnO₄ (\(C_{\text{KMnO}_4}\)) : \(0.0020 \, \text{mol/L}\)
- Volume de KMnO₄ versé pour atteindre le point de virage (\(V_{\text{KMnO}_4}\)) : \(6.20 \, \text{mL}\)
- Masse molaire du fer (Fe) : \(55.845 \, \text{g/mol}\)
Schéma du Montage de Titration Redox
Titration d'un échantillon d'eau contenant du Fe²⁺ avec une solution de KMnO₄.
Questions à traiter
- Convertir le volume de l'échantillon d'eau en litres (L).
- Convertir le volume de KMnO₄ versé en litres (L).
- Calculer le nombre de moles de KMnO₄ (\(n_{\text{KMnO}_4}\)) utilisées pour la titration.
- Déterminer le nombre de moles d'ions Fe²⁺ (\(n_{\text{Fe}^{2+}}\)) dans l'échantillon d'eau, en utilisant la stœchiométrie de la réaction.
- Calculer la masse d'ions Fe²⁺ (\(m_{\text{Fe}^{2+}}\)) dans l'échantillon.
- Calculer la concentration massique des ions Fe²⁺ dans l'eau de source en milligrammes par litre (mg/L).
Correction : Analyse Quantitative de Fe²⁺
Question 1 : Conversion du Volume de l'Échantillon d'Eau en Litres
Principe :
Le volume est donné en millilitres (mL) et doit être converti en litres (L) pour les calculs de concentration.
Relation :
Données spécifiques :
- Volume de l'échantillon d'eau (\(V_{\text{eau}}\)) : \(50.0 \, \text{mL}\)
Calcul :
Question 2 : Conversion du Volume de KMnO₄ Versé en Litres
Principe :
De même, le volume de KMnO₄ est donné en millilitres (mL) et doit être converti en litres (L).
Relation :
Données spécifiques :
- Volume de KMnO₄ versé (\(V_{\text{KMnO}_4}\)) : \(6.20 \, \text{mL}\)
Calcul :
Quiz Intermédiaire 1 : Un volume de 2.5 mL de titrant est équivalent à :
Question 3 : Calcul du Nombre de Moles de KMnO₄ Utilisées (\(n_{\text{KMnO}_4}\))
Principe :
Le nombre de moles (\(n\)) d'un soluté est calculé en multipliant sa concentration molaire (\(C\)) par le volume de la solution (\(V\)).
Formule(s) utilisée(s) :
Données spécifiques :
- Concentration de KMnO₄ (\(C_{\text{KMnO}_4}\)) : \(0.0020 \, \text{mol/L}\)
- Volume de KMnO₄ versé (\(V_{\text{KMnO}_4}\)) : \(0.00620 \, \text{L}\)
Calcul :
Question 4 : Détermination du Nombre de Moles d'Ions Fe²⁺ (\(n_{\text{Fe}^{2+}}\))
Principe :
La stœchiométrie de la réaction redox donnée est : \(\text{MnO}_4^- + 8\text{H}^+ + 5\text{Fe}^{2+} \rightarrow \text{Mn}^{2+} + 5\text{Fe}^{3+} + 4\text{H}_2\text{O}\). Cette équation indique que 1 mole d'ions permanganate (MnO₄⁻, provenant du KMnO₄) réagit avec 5 moles d'ions ferreux (Fe²⁺).
Relation stœchiométrique :
Données calculées :
- Nombre de moles de KMnO₄ (\(n_{\text{KMnO}_4}\)) : \(1.24 \times 10^{-5} \, \text{mol}\)
Calcul :
Question 5 : Calcul de la Masse d'Ions Fe²⁺ (\(m_{\text{Fe}^{2+}}\))
Principe :
La masse (\(m\)) d'une substance est obtenue en multipliant son nombre de moles (\(n\)) par sa masse molaire (\(M\)).
Formule(s) utilisée(s) :
Données spécifiques et calculées :
- Nombre de moles de Fe²⁺ (\(n_{\text{Fe}^{2+}}\)) : \(6.20 \times 10^{-5} \, \text{mol}\)
- Masse molaire du Fer (\(M_{\text{Fe}}\)) : \(55.845 \, \text{g/mol}\)
Calcul :
Conversion en milligrammes (mg) :
Arrondi à trois chiffres significatifs (comme \(V_{\text{KMnO}_4}\)) : \(3.46 \, \text{mg}\).
Question 6 : Calcul de la Concentration Massique des Ions Fe²⁺ en mg/L
Principe :
La concentration massique est la masse de soluté (Fe²⁺) par litre d'échantillon d'eau.
Formule(s) utilisée(s) :
Données calculées :
- Masse de Fe²⁺ (\(m_{\text{Fe}^{2+}}\)) : \(3.46 \, \text{mg}\)
- Volume de l'échantillon d'eau (\(V_{\text{eau}}\)) : \(0.0500 \, \text{L}\)
Calcul :
Quiz Intermédiaire 2 : Si 2.0 mg de Fe²⁺ sont trouvés dans 100 mL d'eau, quelle est la concentration en mg/L ?
Quiz Rapide : Testez vos connaissances (Récapitulatif)
1. Dans la réaction \(\text{MnO}_4^- + 8\text{H}^+ + 5\text{Fe}^{2+} \rightarrow \text{Mn}^{2+} + 5\text{Fe}^{3+} + 4\text{H}_2\text{O}\), le Fe²⁺ est :
2. La stœchiométrie de la réaction indique que pour chaque mole de MnO₄⁻ qui réagit, combien de moles de Fe²⁺ réagissent ?
3. Si la concentration de Fe²⁺ dans une eau est élevée, cela peut indiquer :
Glossaire
- Titration Redox
- Type de titration basé sur une réaction d'oxydoréduction entre l'analyte et le titrant.
- Oxydoréduction (Réaction Redox)
- Réaction chimique au cours de laquelle il y a un transfert d'électrons entre les réactifs. Implique un agent oxydant (qui gagne des électrons et est réduit) et un agent réducteur (qui perd des électrons et est oxydé).
- Permanganate de Potassium (KMnO₄)
- Composé chimique utilisé comme agent oxydant puissant dans de nombreuses titrations redox. Sa couleur violette intense disparaît lorsqu'il est réduit en ion Mn²⁺ (incolore ou rose très pâle), ce qui permet de l'utiliser comme son propre indicateur.
- Ions Ferreux (Fe²⁺)
- Forme du fer avec un état d'oxydation de +2. Dans les titrations avec KMnO₄, Fe²⁺ est oxydé en Fe³⁺ (ions ferriques).
- Stœchiométrie
- Étude des rapports quantitatifs entre les réactifs et les produits dans une réaction chimique.
D’autres exercices de chimie analytique:






0 commentaires